Glicyna to organiczny związek chemiczny należący do aminokwasów endogennych, jest naturalnie syntezowana w organizmie człowieka z prekursorów takich jak cholina, seryna czy hydroksyprolina. Ten prosty aminokwas pełni kluczowe funkcje w wielu procesach fizjologicznych, wpływając korzystnie na zdrowie skóry, włosów, układu kostnego, mięśniowego i nerwowego.
Ten artykuł wszechstronne omawia właściwości glicyny, jej zastosowania, dawkowanie oraz potencjalne skutki uboczne suplementacji.
Czym jest glicyna? Wzór chemiczny i synteza
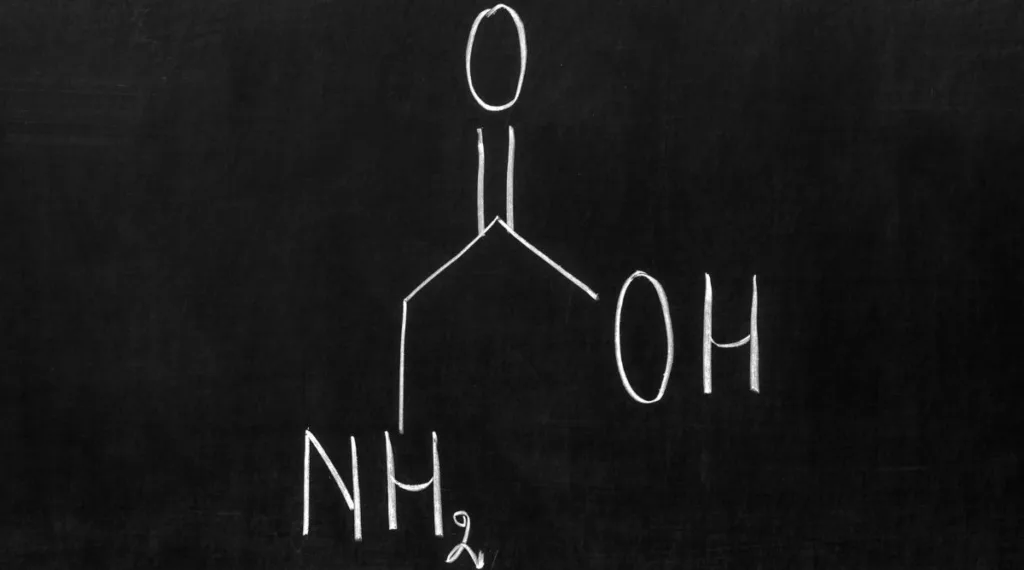
Glicyna (Gly, G) to najprostszy aminokwas białkowy o wzorze chemicznym NH2-CH2-COOH. Jako aminokwas endogenny, jest syntetyzowana wewnątrz organizmu z innych związków, takich jak cholina (witamina B4), seryna (aminokwas polarny) czy hydroksyprolina (aminokwas występujący głównie w kolagenie). Glicyna należy do aminokwasów niezbędnych, co oznacza, że organizm musi ją dostarczać w odpowiedniej ilości dla prawidłowego funkcjonowania.
Tabela 1. Wzór i właściwości glicyny
| Cecha | Opis |
|---|---|
| Wzór chemiczny | NH2-CH2-COOH |
| Masa molowa | 75,07 g/mol |
| Temperatura topnienia | 233°C |
| Rozpuszczalność w wodzie | 25 g/100 ml (20°C) |
Degradacja glicyny w organizmach zwierząt i ludzi
Degradacja glicyny zachodzi głównie poprzez mitochondrialny układ rozkładający glicynę (GCS), złożony kompleks enzymatyczny katalizujący odwracalną reakcję przekształcenia glicyny do seryny, z jednoczesnym wytworzeniem N5,N10-metylenotetrahydrofolanu i amoniaku. Defekty genetyczne GCS prowadzą do niedoboru glicyny i poważnych zaburzeń neurologicznych znanych jako hiperglicynemia nieketotyczna. Glicyna może być także przekształcana z powrotem do seryny przez SHMT, w reakcji odwracalnej do syntezy glicyny z seryny. Ilościowo mniej istotną drogą katabolizmu glicyny jest jej utlenienie do glioksolanu przez oksydazę D-aminokwasów. Tempo degradacji glicyny jest regulowane hormonalnie i żywieniowo, np. glukagon i wysokobiałkowa dieta nasilają aktywność GCS i rozpad glicyny.
Receptory i transportery glicyny w układzie nerwowym
Glicyna, aby wywierać swoje liczne efekty biologiczne, musi oddziaływać z różnymi receptorami i być transportowana przez specyficzne białka. Dwa główne rodzaje receptorów dla glicyny to receptory glicynowe (GlyR) oraz receptor NMDA, podczas gdy za jej wychwyt i regulację stężenia odpowiadają transportery GlyT1 i GlyT2.
Receptory glicynowe (GlyR) są kanałami jonowymi bramkowanymi ligandem, selektywnie przepuszczalnymi dla jonów chlorkowych. Aktywacja GlyR przez glicynę prowadzi do hiperpolaryzacji błony komórkowej i zahamowania transmisji synaptycznej. GlyR występują głównie w ośrodkowym układzie nerwowym (OUN), szczególnie w rdzeniu kręgowym i pniu mózgu, gdzie pełnią kluczową rolę w regulacji odruchu monosynaptycznego i kontroli ruchowej. Ponadto, GlyR są obecne w innych tkankach, takich jak układ odpornościowy, gdzie modulują aktywność komórek immunologicznych.
Receptor NMDA (N-metylo-D-asparaginian) jest jonotropowym receptorem glutaminianergicznym, będącym jednocześnie receptorem dla glicyny. W receptorze NMDA, glicyna pełni rolę kofaktora, niezbędnego do aktywacji receptora przez glutaminian. Kompleks NMDA-glicyna-glutaminian jest istotny w procesach plastyczności synaptycznej, uczenia się i pamięci oraz przetwarzania informacji bólowej. Zaburzenia w funkcjonowaniu receptora NMDA są związane z różnymi schorzeniami neurologicznymi i psychiatrycznymi, takimi jak choroba Alzheimera, schizofrenia czy depresja.
Transportery glicyny, GlyT1 i GlyT2, należą do rodziny transporterów Na+/Cl–zależnych i są odpowiedzialne za regulację stężenia glicyny w synapsach. GlyT1 jest zlokalizowany głównie na komórkach glejowych i neuronach w OUN, gdzie uczestniczy w wychwycie zwrotnym glicyny ze szczeliny synaptycznej, regulując siłę i czas trwania transmisji glicynergicznej. GlyT2 natomiast występuje przede wszystkim na presynaptycznych zakończeniach neuronów glicynergicznych i jest zaangażowany w wychwyt glicyny do pęcherzyków synaptycznych, umożliwiając jej dostępność do dalszego uwalniania.
Tabela 2. Receptory i transportery glicyny, oraz ich funkcje
| Receptor/transporter | Lokalizacja | Funkcja |
|---|---|---|
| Receptor GlyR | OUN (rdzeń kręgowy, pień mózgu), układ odpornościowy | Regulacja transmisji hamującej, modulacja aktywności immunologicznej |
| Receptor NMDA | OUN (kora mózgowa, hipokamp, móżdżek) | Plastyczność synaptyczna, uczenie się i pamięć, przetwarzanie bólu |
| Transporter GlyT1 | Komórki glejowe i neurony w OUN | Wychwyt zwrotny glicyny, regulacja transmisji glicynergicznej |
| Transporter GlyT2 | Presynaptyczne zakończenia neuronów glicynergicznych | Wychwyt glicyny do pęcherzyków synaptycznych |
Zaburzenia w funkcjonowaniu receptorów i transporterów glicyny mogą prowadzić do różnych stanów patologicznych. Mutacje w genach kodujących podjednostki GlyR są związane z hiperpleksją, rzadkim zaburzeniem neurologicznym charakteryzującym się nadmierną reakcją przestrachu i sztywnością mięśni. Z kolei, dysfunkcja transporterów glicyny może przyczyniać się do rozwoju bólu neuropatycznego czy schizofrenii.
Receptory i transportery glicyny stanowią obiecujące cele terapeutyczne. Agoniści i pozytywne modulatory allosteryczne GlyR są badane jako potencjalne leki przeciwbólowe, przeciwlękowe i neuroprotekcyjne. Inhibitory GlyT1, takie jak sarkozyna czy bitopertin, są testowane w terapii schizofrenii, jako potencjalne leki wspomagające działanie przeciwpsychotyczne. Natomiast, inhibitory GlyT2 mogą znaleźć zastosowanie w leczeniu bólu neuropatycznego.
Fizjologiczne właściwości glicyny
Glicyna pełni w organizmie wiele istotnych funkcji fizjologicznych:
- Jest głównym składnikiem kolagenu i elastyny, stanowiąc odpowiednio 11,5% i 20% reszt aminokwasowych w tych białkach. Jej obecność co trzecia reszta w sekwencji kolagenu jest niezbędna dla stabilizacji potrójnej helisy.
- Bierze udział w koniugacji kwasów żółciowych w wątrobie, co jest niezbędne dla trawienia i wchłaniania lipidów w jelicie.
- Jako ligand receptora glicynowego (kanału chlorkowego) w leukocytach i makrofagach, glicyna moduluje poziom wapnia wewnątrzkomórkowego, regulując w ten sposób wytwarzanie cytokin, produkcję wolnych rodników i odpowiedź immunologiczną.
- Pełni rolę neuroprzekaźnika hamującego w ośrodkowym układzie nerwowym, regulując homeostazę organizmu.
- Uczestniczy w biosyntezie związków o kluczowym znaczeniu fizjologicznym (Tabela 3).
Tabela 3. Biosynteza ważnych związków z udziałem glicyny
| Związek | Funkcja |
|---|---|
| Glutation | Główny wewnątrzkomórkowy przeciwutleniacz |
| Hem | Składnik hemoglobiny i cytochromów |
| Kreatyna | Magazynowanie energii w mięśniach i innych narządach |
| Puryny | Składniki DNA, RNA i kofaktorów enzymatycznych (np. NAD, NADP) |
Zaburzenia metabolizmu i niedobory glicyny mają zatem wielorakie negatywne konsekwencje dla funkcjonowania organizmu.
Niedobór glicyny a otyłość i cukrzyca
Otyłość i cukrzyca typu 2 to narastające problemy zdrowia publicznego, związane z insulinoopornością, przewlekłym stanem zapalnym i stresem oksydacyjnym. Interesujące, że u osób otyłych i diabetyków obserwuje się obniżone stężenia glicyny w osoczu. Sugeruje to, że niedobory glicyny mogą odgrywać rolę w patogenezie tych chorób.
Dane z badań na zwierzętach i nielicznych badań klinicznych wskazują, że suplementacja glicyną może przynosić korzystne efekty w zaburzeniach metabolicznych towarzyszących otyłości i cukrzycy, poprzez:
- Poprawę wrażliwości tkanek na insulinę
- Nasilenie syntezy glutationu i poprawa statusu antyoksydacyjnego
- Zmniejszenie stanu zapalnego poprzez hamowanie aktywacji NFkB i wydzielania cytokin prozapalnych
- Normalizację wydzielania VLDL z wątroby poprzez regulację szlaków sygnałowych zależnych od receptora NMDA
Glicyna działa cytoprotekcyjnie i przeciwzapalnie
Stres oksydacyjny i apoptoza komórek są wspólnymi mechanizmami patogenetycznymi wielu chorób, w tym m.in. uszkodzeń niedokrwienno-reperfuzyjnych, chorób neurodegeneracyjnych czy nowotworów. Glicyna wykazuje działanie cytoprotekcyjne w różnych tkankach i narządach, prawdopodobnie dzięki:
- Hamowaniu apoptozy komórek śródbłonka poprzez zmniejszenie ekspresji białek proapoptotycznych (Bax, kaspaza-3) i indukcję białek antyapoptotycznych (Bcl-2)
- Zmniejszaniu napływu Ca2+ do komórek przez aktywację receptora glicynowego i hamowanie kanałów wapniowych typu L
- Zwiększaniu biodostępności tlenku azotu w naczyniach krwionośnych poprzez ograniczenie jego utleniania w mechanizmie zależnym od glutationu
- Aktywacji receptora NMDA i wazodylatacji zależnej od tlenku azotu
- Zwiększaniu syntezy glutationu w komórkach
W modelach zwierzęcych zaobserwowano, że glicyna hamuje patologiczną angiogenezę związaną z rozwojem nowotworów, jednakże potencjalne zastosowanie glicyny jako składnika terapii cytoprotekcyjnych i przeciwnowotworowych wymaga potwierdzenia w badaniach klinicznych.
Wpływ glicyny na sen – badania naukowe

Glicyna, będąc aminokwasem niezbędnym, wykazuje obiecujący potencjał w poprawie jakości snu. Szereg badań klinicznych z udziałem zdrowych ochotników lub doświadczających niezadowalającej jakości snu wskazuje, że suplementacja 3 g glicyny przed snem może subiektywnie i obiektywnie poprawiać sen.
W jednym z badań (Inagawa et al., 2006), ochotnicy otrzymywali 3 g glicyny lub placebo przed snem. Subiektywna ocena jakości snu za pomocą standaryzowanych kwestionariuszy (St. Mary’s Hospital Sleep Questionnaire i Space-Aeromedicine Fatigue Checklist) wykazała, że glicyna istotnie zmniejszała uczucie zmęczenia, zwiększała energię i poprawiała przejrzystość umysłu po przebudzeniu. Sugeruje to, że glicyna może wywierać korzystny wpływ na subiektywne odczucia związane ze snem.
Inne badanie (Yamadera et al., 2007) potwierdziło te obserwacje i dostarczyło obiektywnych dowodów na poprawę snu przez glicynę. U ochotników z przewlekłymi zaburzeniami snu, suplementacja 3 g glicyny skróciła latencję snu i czas do pojawienia się snu wolnofalowego (SWS) w badaniu polisomnograficznym (PSG), bez wpływu na architekturę snu. Glicyna poprawiła także subiektywną satysfakcję ze snu i efektywność snu. Co istotne, glicyna nie powodowała typowych dla leków nasennych (takich jak benzodiazepiny) zaburzeń architektury snu (np. redukcji snu REM) ani senności w ciągu dnia. Wręcz przeciwnie, glicyna zmniejszała senność i poprawiała funkcje poznawcze przez cały dzień.
W trzecim badaniu (Bannai et al., 2012), ochotnicy byli poddani 25% restrykcji snu przez 3 kolejne noce. Suplementacja 3 g glicyny zmniejszała subiektywne uczucie zmęczenia i senności wywołane ograniczeniem snu, szczególnie w pierwszym dniu restrykcji. Glicyna poprawiała także wyniki w teście czujności psychomotorycznej, wskazując na potencjał w łagodzeniu negatywnych skutków łagodnej deprywacji snu na funkcjonowanie w ciągu dnia.
Mechanizmy, poprzez które glicyna poprawia sen, nie są w pełni poznane, ale mogą obejmować jej działanie jako ko-agonisty receptorów NMDA w jądrze nadskrzyżowaniowym (SCN), kluczowym ośrodku regulacji rytmów okołodobowych. Glicyna może modulować aktywność SCN poprzez wpływ na ekspresję neuropeptydów, takich jak wazopresyna (AVP) i peptyd jelitowy (VIP). Ponadto, badania na zwierzętach sugerują, że glicyna może aktywnie akumulować się w szyszynce, strukturze zaangażowanej w regulację snu.
Suplementacja glicyną przed snem wydaje się obiecującą strategią poprawy subiektywnej i obiektywnej jakości snu, bez typowych skutków ubocznych leków nasennych. Glicyna może skracać latencję snu, przyspieszać pojawienie się snu głębokiego, zmniejszać senność i poprawiać funkcje poznawcze w ciągu dnia. Dalsze badania są potrzebne dla pełnego zrozumienia mechanizmów działania glicyny i ustalenia optymalnych schematów dawkowania. Niemniej jednak, dzięki wysokiemu profilowi bezpieczeństwa, suplementacja glicyną jawi się jako obiecująca opcja wspomagająca higienę snu.
u003cstrongu003ePrzeczytaj także:u003c/strongu003e
Suplementacja glicyny – jakie dawki?
Zalecane dawki glicyny różnią się w zależności od wskazania i grupy wiekowej. W większości badań klinicznych stosowano dawki w zakresie od 3 do 10 g.
W kontekście poprawy jakości snu, typowa dawka glicyny wynosi 3-5 g, przyjmowane 30-60 minut przed snem. Taka dawka była stosowana w większości badań oceniających wpływ glicyny na sen i wykazała korzystne efekty przy jednoczesnym dobrym profilu bezpieczeństwa.
W przypadku wspomagania syntezy kolagenu, keratyny i regeneracji tkanki łącznej, zalecane dawki glicyny wynoszą do 10 g dziennie, najlepiej w połączeniu z innymi aminokwasami, takimi jak prolina i lizyna. Wyższe dawki (do 20 g dziennie) mogą być stosowane w przypadku stanów zwiększonego zapotrzebowania, np. w okresie rekonwalescencji po urazach lub u sportowców intensywnie trenujących. Natomiast w badaniach nad wpływem glicyny na objawy schizofrenii stosowano dawki od 15 do nawet 60 g dziennie.
Ważne jest, aby rozpoczynać suplementację od niższych dawek i stopniowo je zwiększać, monitorując tolerancję i ewentualne efekty uboczne. Niektóre osoby mogą doświadczać dyskomfortu żołądkowo-jelitowego przy wysokich dawkach glicyny, dlatego zaleca się jej przyjmowanie wraz z posiłkiem.
Potencjalne skutki uboczne stosowania glicyny
Suplementacja glicyną jest ogólnie uważana za bezpieczną i dobrze tolerowaną, jednak w niektórych przypadkach mogą wystąpić pewne skutki uboczne. Najczęstszym potencjalnym efektem ubocznym stosowania wysokich dawek glicyny jest dyskomfort żołądkowo-jelitowy. Objawy mogą obejmować:
- Nudności
- Wzdęcia
- Biegunka
- Ból brzucha
- Senność
Objawy te są zwykle łagodne i przemijające, jednak w przypadku utrzymywania się lub nasilenia dolegliwości należy przerwać suplementację i skonsultować się z lekarzem. Przyjmowanie glicyny wraz z posiłkiem może zmniejszyć ryzyko wystąpienia dyskomfortu żołądkowo-jelitowego.
U niektórych osób, szczególnie przy wysokich dawkach, glicyna może powodować uczucie zmęczenia lub senności. Jest to związane z jej działaniem hamującym na ośrodkowy układ nerwowy. Efekt ten może być korzystny w kontekście poprawy jakości snu, jednak w przypadku nadmiernej senności w ciągu dnia należy rozważyć zmniejszenie dawki lub przyjmowanie glicyny tylko przed snem.
Istnieją ograniczone dane dotyczące bezpieczeństwa długotrwałego stosowania wysokich dawek glicyny. Choć jest to aminokwas endogenny, nadmierne spożycie może potencjalnie wpływać na metabolizm innych aminokwasów lub powodować zaburzenia równowagi azotowej. Dlatego zaleca się stosowanie glicyny zgodnie z zalecanymi dawkami i pod nadzorem lekarza w przypadku długotrwałej suplementacji.
Interakcje i przeciwwskazania do suplementacji glicyny
Mimo że glicyna jest aminokwasem endogennym i generalnie uważana jest za bezpieczną, istnieją pewne przeciwwskazania do jej stosowania, które należy wziąć pod uwagę przed rozpoczęciem suplementacji.
Jednym z głównych przeciwwskazań do stosowania glicyny są choroby nerek. W przypadku niewydolności nerek może dochodzić do kumulacji aminokwasów, w tym glicyny, co może potencjalnie nasilać objawy choroby i prowadzić do komplikacji. Pacjenci z chorobami nerek, szczególnie w zaawansowanym stadium, powinni unikać suplementacji glicyną bez konsultacji z lekarzem.
Podobne ograniczenia dotyczą osób z chorobami wątroby. Wątroba jest głównym miejscem metabolizmu aminokwasów, a w przypadku jej dysfunkcji może dochodzić do zaburzeń w przetwarzaniu i eliminacji glicyny. Suplementacja glicyną u osób z chorobami wątroby powinna odbywać się pod ścisłym nadzorem lekarza, po ocenie indywidualnego ryzyka i korzyści.
Glicyna może wchodzić w interakcje z niektórymi lekami, szczególnie tymi wpływającymi na układ nerwowy. Należą do nich:
- Leki przeciwdrgawkowe (np. kwas walproinowy, karbamazepina) – glicyna może nasilać ich działanie, zwiększając ryzyko działań niepożądanych.
- Leki uspokajające i nasenne (np. benzodiazepiny, zolpidem) – glicyna może potencjalizować ich efekty sedatywne i depresyjne na ośrodkowy układ nerwowy.
- Leki przeciwpsychotyczne (np. klozapina, risperidon) – glicyna może wpływać na ich metabolizm i działanie poprzez interakcje z receptorami NMDA.
W przypadku przyjmowania jakichkolwiek leków, szczególnie działających na układ nerwowy, należy skonsultować się z lekarzem przed rozpoczęciem suplementacji glicyną w celu oceny potencjalnych interakcji i dostosowania dawkowania.
Kobiety w ciąży i karmiące piersią powinny zachować ostrożność w stosowaniu glicyny. Choć jest to składnik naturalnie występujący w diecie, brakuje badań oceniających bezpieczeństwo suplementacji glicyną w tych grupach. Przed rozpoczęciem suplementacji zalecana jest konsultacja z lekarzem w celu oceny potencjalnych korzyści i ryzyka.
Osoby z wrażliwością lub alergią na glicynę powinny unikać jej suplementacji. Choć alergiczne reakcje na glicynę są rzadkie, mogą wystąpić objawy, takie jak wysypka, świąd, obrzęk lub trudności w oddychaniu. W przypadku podejrzenia reakcji alergicznej należy przerwać stosowanie glicyny i skonsultować się z lekarzem.
Korzystne interakcje glicyny
Glicyna pełni rolę prekursora dla syntezy innych ważnych aminokwasów, takich jak seryna, cysteina czy metionina. Seryna może być bezpośrednio syntetyzowana z glicyny przez enzym hydroksymetylotransferazę serynową (SHMT). Z kolei cysteina jest syntetyzowana z seryny i metioniny przy udziale enzymu syntazy cystationinowej.
W kontekście syntezy białek, glicyna jest szczególnie ważna dla produkcji kolagenu. Kolagen jest głównym białkiem strukturalnym tkanki łącznej, a glicyna stanowi aż jedną trzecią wszystkich reszt aminokwasowych w cząsteczce kolagenu. Odpowiednia podaż glicyny, wraz z proliną i lizyną, jest kluczowa dla prawidłowej syntezy i funkcjonowania kolagenu.
Glicyna wykazuje synergistyczne działanie z niektórymi aminokwasami w kontekście funkcji układu nerwowego. Wraz z glutaminianem i cysteiną, glicyna jest prekursorem dla syntezy glutationu – kluczowego przeciwutleniacza chroniącego komórki nerwowe przed stresem oksydacyjnym. Niedobory glicyny mogą prowadzić do zmniejszonej produkcji glutationu i zwiększonej podatności neuronów na uszkodzenia.
Ponadto, glicyna i glutaminian są głównymi neuroprzekaźnikami odpowiednio hamującymi i pobudzającymi w ośrodkowym układzie nerwowym. Równowaga między tymi aminokwasami jest kluczowa dla prawidłowej funkcji mózgu. Zaburzenia w stosunku glicyny do glutaminianu są obserwowane w niektórych zaburzeniach neurologicznych, takich jak schizofrenia czy depresja.
Glicyna może również wpływać na metabolizm innych aminokwasów poprzez konkurencję o transportery i szlaki metaboliczne. Nadmierna podaż glicyny może potencjalnie zaburzać wchłanianie i wykorzystanie innych aminokwasów, szczególnie o zbliżonej strukturze, takich jak alanina czy seryna. Dlatego ważne jest, aby suplementacja glicyną odbywała się w zrównoważony sposób, najlepiej pod nadzorem specjalisty.
Warto też wspomnieć o roli glicyny w detoksykacji i metabolizmie substancji toksycznych. Glicyna jest składnikiem koniugatu glicynowego, który jest jednym z głównych szlaków usuwania substancji toksycznych, takich jak benzen czy kwas benzoesowy, z organizmu. Odpowiednia podaż glicyny wspomaga procesy detoksykacji i chroni przed akumulacją szkodliwych substancji.
u003cstrongu003ePrzeczytaj także:u003c/strongu003e
Naturalne źródła glicyny w diecie

Glicyna, będąc aminokwasem endogennym, może być syntetyzowana w organizmie z innych związków, jednak dla optymalnego funkcjonowania ważne jest również dostarczanie jej z dietą. Na szczęście, glicyna występuje naturalnie w wielu produktach spożywczych, zarówno pochodzenia zwierzęcego, jak i roślinnego.
Najbogatszym źródłem glicyny są produkty zwierzęce bogate w kolagen, takie jak:
- Skóra drobiowa
- Żelatyna
- bulion na kościach i chrząstkach zwierzęcych
- Mięso czerwone, szczególnie wołowina i jagnięcina
- Ryby
Inne produkty zwierzęce, takie jak jaja, nabiał czy ryby, również dostarczają glicyny, choć w mniejszych ilościach.
Wśród źródeł roślinnych, glicyna jest obecna w:
- Nasionach roślin strączkowych, takich jak soja, soczewica, ciecierzyca czy fasol
- Produktach sojowych, takich jak tofu czy tempeh
- Orzechach i nasionach, szczególnie sezamie, słoneczniku i dyni
- Pełnoziarnistych produktach zbożowych, takich jak quinoa, owies czy brązowy ryż
Warzywa, takie jak szpinak, kapusta czy brokuły, zawierają mniejsze ilości glicyny, ale spożywane regularnie mogą być cennym uzupełnieniem diety.
Warto podkreślić, że biodostępność glicyny z różnych źródeł pokarmowych może się różnić. Produkty zwierzęce, bogate w kolagen, są uważane za najbardziej przyswajalne źródła glicyny. Z kolei biodostępność glicyny z produktów roślinnych może być niższa ze względu na obecność innych związków, takich jak fityniany czy błonnik, które mogą interferować z wchłanianiem aminokwasów.
Dla osób na diecie wegańskiej lub wegetariańskiej, osiągnięcie odpowiedniej podaży glicyny z samej diety może być wyzwaniem. W takich przypadkach warto rozważyć suplementację glicyną lub innymi prekursorami, takimi jak seryna, pod nadzorem specjalisty.
Podsumowanie: Glicyna to aminokwas o szerokim działaniu
Glicyna jest prostym aminokwasem, który pełni w organizmie człowieka wiele istotnych funkcji fizjologicznych. Jej znaczenie dla zdrowia jest niezaprzeczalne, a potencjalne korzyści z suplementacji są przedmiotem licznych badań naukowych. Podsumowując:
- Glicyna jest kluczowym składnikiem białek strukturalnych, takich jak kolagen i elastyna, warunkujących prawidłowe funkcjonowanie tkanki łącznej, skóry, kości i stawów.
- Pełni rolę neuroprzekaźnika w ośrodkowym układzie nerwowym, regulując sen, nastrój i procesy poznawcze. Suplementacja glicyną może poprawiać jakość snu i koncentrację.
- Wykazuje działanie przeciwzapalne, antyoksydacyjne i detoksykacyjne, chroniąc komórki przed stresem oksydacyjnym i toksycznymi substancjami.
- Niedobory glicyny mogą być powiązane z zaburzeniami metabolicznymi, takimi jak insulinooporność, otyłość i cukrzyca typu 2. Suplementacja może poprawiać profil metaboliczny.
- Glicyna jest generalnie bezpieczna i dobrze tolerowana w zalecanych dawkach. Ostrożność powinny zachować osoby z chorobami nerek i wątroby.
- Źródłami glicyny w diecie są przede wszystkim produkty zwierzęce bogate w kolagen oraz nasiona roślin strączkowych, produkty sojowe, orzechy i pełnoziarniste produkty zbożowe dla wegetarian.
Dalsze badania nad zastosowaniem glicyny w medycynie i profilaktyce chorób cywilizacyjnych są niezbędne dla pełnego zrozumienia jej potencjału terapeutycznego. Niemniej jednak, zadbanie o optymalną podaż tego aminokwasu, czy to przez zbilansowaną dietę, czy rozsądną suplementację, może przynieść wymierne korzyści zdrowotne.
u003cstrongu003eReferencje:u003c/strongu003e
- Tang, N., & Skibsted, L. H. (2016). Calcium binding to amino acids and small glycine peptides in aqueous solution: Toward peptide design for better calcium bioavailability. Journal of agricultural and food chemistry, 64(21), 4376-4389.
- Li, P., & Wu, G. (2018). Roles of dietary glycine, proline, and hydroxyproline in collagen synthesis and animal growth. Amino acids, 50, 29-38.
- Bashir, Z. I., Tam, B., & Collingridge, G. L. (1990). Activation of the glycine site in the NMDA receptor is necessary for the induction of LTP. Neuroscience letters, 108(3), 261-266.
- Heresco-Levy, U., Javitt, D. C., Ermilov, M., Mordel, C., Silipo, G., & Lichtenstein, M. (1999). Efficacy of high-dose glycine in the treatment of enduring negative symptoms of schizophrenia. Archives of general psychiatry, 56(1), 29-36.
- Hall, J. C. (1998). Glycine. Journal of Parenteral and Enteral Nutrition, 22(6), 393-398.
- Xu, T. L., & Gong, N. (2010). Glycine and glycine receptor signaling in hippocampal neurons: diversity, function and regulation. Progress in neurobiology, 91(4), 349-361.
- Wang, W., Wu, Z., Dai, Z., Yang, Y., Wang, J., & Wu, G. (2013). Glycine metabolism in animals and humans: implications for nutrition and health. Amino acids, 45, 463-477.











1 komentarz. Zostaw komentarz
dziękuję za artykuł, mam dobre rezultaty w stosowaniu przy schizofrenii i alzheimerze ,proszę o więcej szczegółów